| |
Главная
|
Метод EAC-розеток. МетодикаМатериалы и оборудование. Для работы необходимы: силиконизированные и центрифужные пробирки (25 и 10 мл), пастеровские пипетки, гематокрит-ная центрифуга, центрифуга Т-23, ротор (10—20 об/мин), пикнометр и аналитические весы, или весы Вестфаля (Johannes-Hammer, Лейпциг), камера для подсчета клеток (Вűrkеr или другой тип), седиментационная камера по Sayk (Dorenburg, Берлин), микроскоп, водяные бани на 37°С и 56°С. Цельную кровь барана, разведенную раствором Олсвера О + О. сохраняют до 8 дней в холодильном шкафу при 4°С. Также необходимо иметь кроличьи гемолизины против эритроцитов барана (Саксонское сывороточное предприятие, Дрезден), свежую мышиную сыворотку, 0, 15М NaCl, среду Игла, изотонический буфер для культивирования клеток (Институт иммунных препаратов и питательных сред, Берлин), гепарин (Gedeon Richter, Будапешт), визотраст 370 (Fahlberg List, Магдебург), декстрансульфат (натриевая соль, отн. мол. масса 500) (Pharmacia, Швеция). рН среды Игла и изотонического раствора для культивирования клеток доводят до 7,3—7,4. Готовят разделяющий раствор следующего состава:
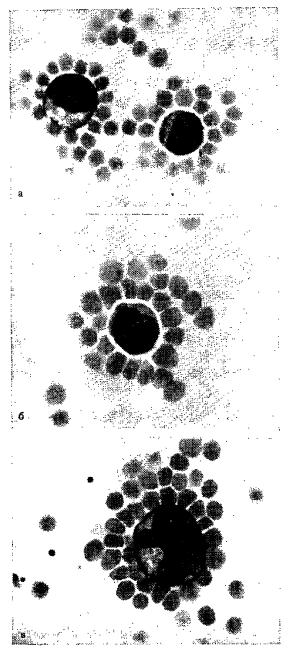
Устанавливают плотность 1,078—1,081 при помощи пикнометра и аналитических весов (или весы Вестфаля). Разделяющий раствор хранят на холоду в темной склянке с притертой пробкой. Выделение лимфоцитовГепаринизированную кровь в количестве 2—4 мл (100 ЕД гепарина на 1 мл) разводят средой Игла в соотношении 1 : 4 и 1 : 6 и осторожно наслаивают на 3—5 мл разделяющего раствора в центрифужных пробирках на 25 мл, центрифугируют 20—40 мин при 600 g и комнатной температуре. Лимфоциты скапливаются в виде белого слоя на границе разделяющего слоя и среды Игла. Их отбирают пастеровской пипеткой и трижды по 10 мин отмывают средой при комнатной температуре. Центрифугируют дважды при 600 g и 1 раз при 200 g для уменьшения примеси тромбоцитов. Концентрацию суспензии доводят до Зх109 клеток/л (среда Игла). Различные варианты контроля дают в среднем 93°/о лимфоцитов, 4% моноцитов, 3% гранулоцитов. Долю моноцитов можно снизить до 1 % и меньше по методу Gu, однако это для метода ЕАС-розеток не имеет особого значения. Сенсибилизация эритроцитов барана ЭБ, смешанные с раствором Олсвера, осаждают центрифугированием и дважды отмывают ФСБ или 0,15 NaCl. Ресуспендируют осадок в среде Игла и доводят гематокрит до 0,05. Сенсибилизацию ЭБ проводят инактивированием гемолизином кролика, разведенным до субагглютинирующей концентрации изотоническим буфером. Для получения оптимальных концентраций амбоцептора проверяют несколько степеней разведения, выраженных в титрах гемолизина. При титре гемолизина 1:12 000 и титре агглютининов 1:50 исследовали разведения 1 : 100, 1 : 200, 1 : 500 и 1 : 1000. Наилучшие результаты получаются при разведении 1 : 500. При использовании инактивированных кроличьих антисывороток к антигену Форссмана или ЭБ необходимые разведения не совпадают. По данным различных авторов, степень разведения колеблется от 1 : 500 до 1 : 2000. Суспензию эритроцитов (гематокрит 0,05) смешивают с равным объемом разведенного амбоцептора и инкубируют в течение 30 мин при 37 °С на водяной бане. Суспензию эритроцитов в ходе инкубации многократно перемешивают. После инкубации сенсибилизированные ЭБ дважды отмывают в изотоническом буферном растворе, ресуспендируют в среде Игла и устанавливают гематокрит 0,05. Получение комплекса антитела — эритроциты — комплемент В качестве комплемента используют свежую сыворотку мышей, разведенную средой Игла в соотношении 1 : 10. К 1 мл суспензии сенсибилизированных эритроцитов (гематокрит 0,05) добавляют 1 мл разведенной мышиной сыворотки. Смесь инкубируют 30 мин при 37 °С, трижды отмывают ФСБ и доводят средой Игла гематокрит до 0,005. Для контроля активности комплемента можно использовать инактивированную мышиную сыворотку (30 минут, 56 °С). ИнкубацияСуспензию эритроциты — антитела — комплемент (ЕАС) с гематокритом 0,005 (0,5 мл) в центрифужных пробирках объемом 10 мл с 0,5 мл суспензии лимфоцитов инкубируют 15 мин при 37°С на водяной бане, периодически перемешивая. Затем центрифугируют 5 мин при 200 g и наконец суспендируют при комнатной температуре в роторе (10 качаний в минуту) или вручную (очень осторожно) . Оценка результатовКлеточную суспензию (1—2 капли) наносят на сетку счетной камеры, используя для этого пипетку с широким носиком. После наложения покровного стекла производят подсчет розеток» нерозеткообразующих мононуклеаров (микроскопия). За РОК принимают клетки, несущие три и более эритроцита на своей поверхности. Часто встречаются розетки в виде морулы. Однако ее не следует путать с группами агглютинировавших эритроцитов, т. е. в центре морулы должна присутствовать ядерная клетка. Подсчитывают 200—300 клеток и вычисляют процент розеток. В норме ЕАС-розетки составляют 10— 20% клеток. Лимфоциты с рецепторами к комплементу
а— лимфоциты; б — лимфоцит; в — лимфоидиая клетка Для точной дифференциации РОК от других клеток рекомендуется седиментация клеточной суспензии в камере Sayk. Обычно достаточно морфологической оценки при окраске по Паппенгейму. Розеткообразующие моноциты с уверенностью можно отдифференцировать гистохимически по наличию пероксидазы или α-нафтилацетатэстеразы. Иногда среди клеток, образующих ЕАС-розетки, моноциты не обнаруживаются. |