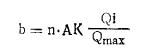
| |
Главная
|
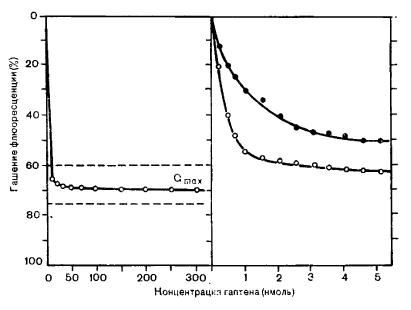
Определение аффинности путем измерения гашения флюоресценцииМатериалы и оборудование Еще один метод определения константы ассоциации антител основан на феномене гашения флюоресценции при взаимодействии с некоторыми гаптенами. Молекулы антител, облучаемые УФ лучами с длиной волны 280—295 нм, испускают флюоресцентное излучение с длиной волны 345 нм. Такое соотношение длин волн возбуждающего и эмиссионного излучения характерно для триптофана. Другие ароматические аминокислоты (тирозин и фенилаланин) также флюоресцируют, но их абсорбционные и эмиссионные максимумы находятся в области еще более коротких длин волн и отличаются малой интенсивностью. Связывание подходящего лиганда антителами сопровождается переносом энергии возбужденных остатков триптофана на связанный лиганд, что сопровождается исчезновением флюоресценции в типичной области. Результатом переноса энергии, таким образом, является гашение триптофановой флюоресценции молекул антител. Энергия возбуждения может передаваться внутри молекулы антитела на расстояние Fab-фрагмента, т. е. приблизительно на 5 нм. Эффективность переноса энергии зависит, во-первых, от ориентации возбужденных остатков триптофана по отношению к связанному лиганду, во-вторых, от степени перекрывания спектра флюоресценции антитела и спектра поглощения лиганда. Особенно хорошо наблюдается тушение с нитроароматическими лигандами, например, ДНФ и ТНФ. Полное замещение лигандами участков связывания антител приводит к гашению определенной части общей триптофановой флюоресценции. Эта максимальная степень гашения флюоресценции (Qmax) должна быть определена в эксперименте, поскольку различные параметры антител неоднородны в этом отношении. В первом приближении степень гашения флюоресценции зависит от числа «занятых» участков связывания антител. При известной концентрации антител и лиганда по степени гашения Qi/Qmax можно судить о количестве связанного с антителами лиганда (r) и свободного лиганда (с). В настоящей главе этот метод будет рассмотрен применительно к анти-ДНФ-антителам. Материалы и оборудованиеСпектрофотометр; Постановка опытаВ термостатируемую кювету флюориметра вносят 1 мл раствора антител. После стабилизации температуры образец облучают УФ светом с длиной волны 280—295 нм и регистрируют интенсивность флюоресценции на длине волны 345 нм. В полученные данные вводят поправку на флюоресценцию растворителя. Раствор АТ (антитело) облучают УФ светом только во время измерения флюоресценции. Раствор гаптена добавляют вначале порциями по 10 мкл, затем — по 20 мкл, до тех пор пока объем добавленного гаптена не достигнет 200 мкл. Концентрация ε-ДНФ-L-лизина должна составлять около 10-5 М. После каждого прибавления гаптена смесь необходимо тщательно перемешивать. Можно наносить раствор гаптена пипеткой на стеклянную палочку с расплющенным концом, который затем переносят в раствор антител и перемешивают. После каждого добавления гаптена измеряют интенсивность флюоресценции (Qi). Для оценки связывания необходимо определять максимальное гашение флюоресценции (Qmax) для каждого препарата антител. Насыщение участков связывания антител устанавливают титрованием 1х10-3 М раствором гаптена. Получаемое при такой концентрации гаптена гашение флюоресценции должно быть откорригировано параллельным титрованием нормального иммуноглобулин. Титрование проводят до молярного избытка гаптена, равного 200:1, к участкам связывания AT. При этом практически все участки связывания оказываются «занятыми». Дальнейшее увеличение концентрации гаптена не увеличивает специфического гашения флюоресценции. Оценка результатовНа рисунке представлены кривые титрования для определения Qmax и аффинности анти-ДНФ-кролика. Гашение флюоресценции при помощи специфических кроличьих анти-ДНФ-антител при титровании гаптеном — ε-ДНФ-L-лизином
Справа: титрование двух различных препаратов АТ (антитело) с целью определения их
аффинности. Низкоаффинные АТ (антитело) (1): Ко=6Х105 М-1;
высокоаффннные АТ (антитело) (2): Ko=l,5X105 М-1. Количество связанного гаптена после каждой добавки рассчитывается по следующей формуле:
где Qi — гашение флюоресценции после внесения соответствующего гаптена; b — количество связанного гаптена; АК — молярная концентрация антител; n — число участков связывания на молекулу AT; Qmax — максимальное гашение флюоресценции при полном связывании антител гаптеном. При помощи (b) рассчитывают молярное соотношение связанного гаптена с антителами (r). Количество свободного гаптена (с) равно разности количеств добавленного гаптена и связанного гаптена (b). Определение истинной средней константы ассоциации проводят по уравнению Сипса. Оценка методаИзучение гашения флюоресценции при оценке аффинности АТ (антитело) имеет по сравнению с другими описанными методами то преимущество, что оно требует очень малого количества антител, оно в 100—10 раз меньше, чем необходимо при использовании других методов. Титрование не занимает много времени, приблизительно 15 минут. Также становится возможным исследование АТ (антитело) в экстремальных условиях (температура, рН, ионная сила, влияние макромолекул), приводящих к денатурации белков при длительном воздействии. К числу недостатков метода следует отнести неудобства, связанные с использованием высокоочищенных антител и ограниченного круга гаптенов. Наилучшие результаты до настоящего времени получены при работе с нитрофенильным гаптеном. Данные, полученные методом гашения флюоресценции, менее точны, чем при равновесном диализе, поскольку определение аффинности основано на вторичном феномене связывания гаптена антителами. |